
ワインを学ぶ上で「覚える」ことも必要ですが、「理解する」ことはそれ以上に大切です。
その上で中学・高校で勉強した知識が役立つことは少なくありません。
多くの方にとって高校化学なんて遠い昔の話。でもそれがワインの理解を助けるんです。
まずは基本となる無機化学の分野から、高校化学で習った内容をワインに関連しそうなところだけ振り返ります。
前後編ともに、奥田 大輔 さん @okkuudaaman に監修いただきました。
お忙しい時間の合間を縫って、間違いの修正など無償でご協力頂いたことに感謝申し上げます。
またこちらのサイトを大変参考にさせていただきました!
化学における有機と無機とは
有機物とは、炭素を含む化合物のうち、構造が単純でないものを指します。
例えば化学式「CO2」で表される二酸化炭素は無機物の扱いですが、化学式「C2H6O」で表されるアルコールは有機化合物という扱いです。
無機化学の基本的なところは必修だったはずですので、高校を卒業されている多くの方はなんとなく記憶に残っていることでしょう。
それに対して私のころの教育課程では、確か有機化学は化学Ⅲで選択科目だったと記憶しています。故に文系選択や専門系の高校の方は習っていないかも。
よって無機と有機で前後半に分けまして、紹介してまいります。
原子の構造と周期律表
中学校で初めて目にし、上3段くらいを覚えさせられた元素周期律表。
元素の名前だけ覚えても何の意味もありません。
大事なのは、この表の「周期」の意味。原子核と電子の構造がその元素の性質にどう影響するかを理解することです。
物質を形作るもの
私たちが普段目にし触れているモノの、最小単位は何でしょうか。
例えば空気。空気は約8割の窒素と約2割の酸素、それから二酸化炭素とその他微量の成分の”混合物”です。混ざっているもの。だからその成分に分けることができます。
この時の「窒素」「酸素」「二酸化炭素」というのは「分子」という単位になります。分子という単位は、その性質を保ってこれ以上分けられない最小の単位です。
この分子がどれほど小さいか。もしくはどれほど多く存在しているか。
諸条件を無視して言うなら、22.4Lの気体の中に6×1023個の分子が含まれています。一応「万」「億」・・・という日本語で表すなら、6千「垓(がい)」というとてつもない数字です。
分子をさらに分けると、「元素」もしくは「原子」という単位に分けられます。二酸化炭素CO2を元素に分解してしまえば、もう二酸化炭素の性質は持ちません。
原子核の構造
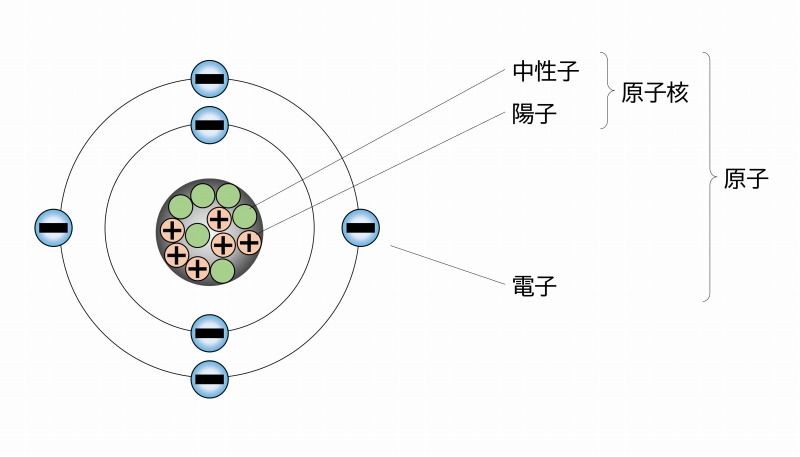
この元素はマイナスの電荷をもった「電子」(e-)とプラスの電荷を持った原子核で構成されています。
原子核はプラスの電荷を持った「陽子」と電荷を持たない「中性子」とがくっついてできています。
イメージとしては、地球の周りをまわる月。地球が原子核で月が電子です。
炭素と窒素と酸素などで何が違うかというと、この電子・陽子・中性子の数です。
通常の状態で陽子と電子の数は同じ。この数が元素番号です。
現在地球上では百数十の元素が確認されていますが、すべてこの電子・陽子・中性子の数の違いだけです。
もっと言うなら、高校の化学・物理で習う範囲の物理的・科学的な現象は、ほとんどこのたった3つの相互作用で説明がついてしまうのです。
原子量と分子量
陽子と中性子の質量はだいたい同じです。そして電子はこの2つと比べると非常に軽く無視できるくらい。
なので陽子1つの質量を1と考え、陽子と中性子の合計数を表したのが「原子量」です。
(正確な定義は違いますが、そこまで理解する必要はありません)
分子を構成する元素の原子量を合計したもの。これが分子量です。
例えば二酸化炭素CO2の分子量は、C:12+O:16×2で44です。

この44という数字は、気体の質量ともリンクします。二酸化炭素の分子が6×1023個集まれば、44gです。
この6×1023個という単位が分子の数を扱うときに必要になるので、1mol(モル)と定義されています。
原子の電子配置
原子核と電子を地球と月に例えましたが、イメージとしてはこのとおり決まった軌道を電子が回っているイメージを持ってください。
(電子の性質を突き詰めると、大学で勉強する量子力学の範囲になります)
ただし月と違うのは、同じ軌道に複数の電子が入ること。
そして元素が大きくなると何重もの電子の軌道を持つことです。
この電子の軌道の数が、元素周期律表の上から何段目かに一致します。
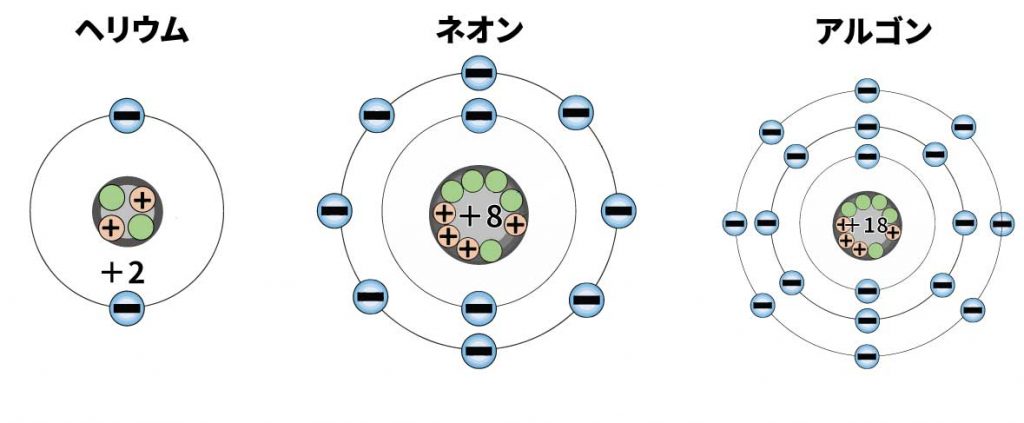
たとえば一段目の水素とヘリウム。電子はそれぞれ1個と2個。1段目の軌道には電子は最大2個です。
二段目のリチウムからネオンまで。ここには電子が8個入ります。
三段目のナトリウムからアルゴンまで。最大の電子数は18個です。
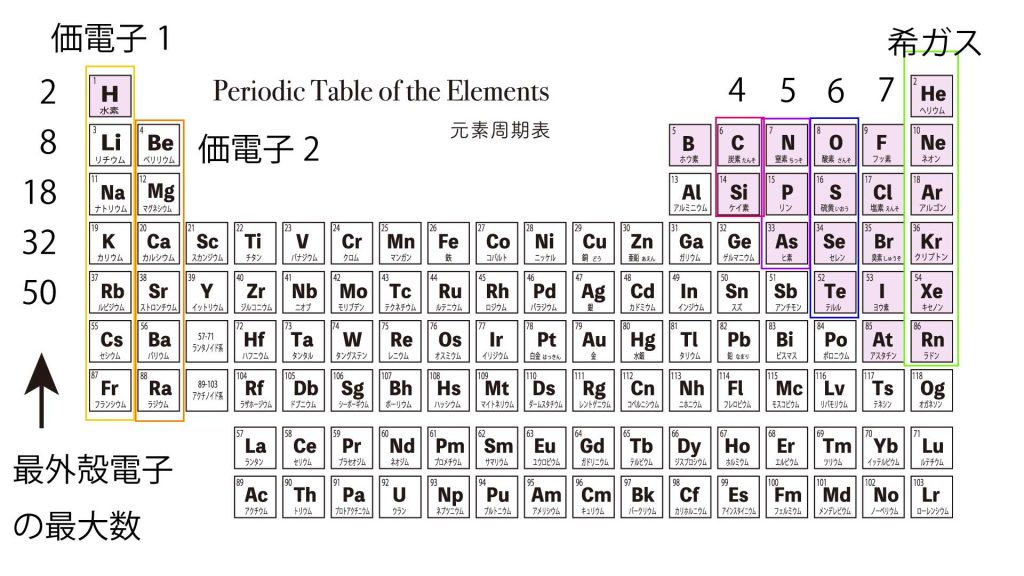
この「最外殻の電子の数」が、元素の性質を決めます。
だから、元素周期律表では上下の元素の性質が似ているのです。
元素の安定
この最外殻電子の数いっぱいに電子が入っているか、もしくは8個だと、元素が安定します。
安定というのは、反応性に乏しくなるということ。他の元素と結びつく性質が一番弱くなるのです。
イメージとして、「席がピッタリ埋まると落ち着く」と覚えてください。
最外殻電子が埋まった状態というのは、元素周期律表の一番右側。ヘリウム、ネオン、アルゴン、クリプトン、キセノンなどは、「希ガス」と呼ばれます。
これらは基本的に分子をつくりません。何にもくっつかないのです。だから希ガス原子=希ガス分子。そして分子同士の結びつきも弱いので、気体になりやすい。液体や固体になりにくいのです。
例えばこのアルゴンという気体。原子量40で酸素(32)や窒素(28)の分子より重いため、下に沈みやすい性質を持ちます。
さらに反応性に乏しいため、他の物質に影響を与えません。
だからワインの保管グッズとして用いられます。ワインの表面をアルゴンガスが覆うことで、酸素と触れにくくなるのです。
この最外殻電子が埋まると安定するという性質。次の元素の結合にも非常に関係します。
他の段は一旦いいです。2段目、「電子が8になれば落ち着く」と覚えてください。
元素の結合の仕組み 共有結合
元素は「電子を共有する」ということができます。満枠じゃない最外殻電子を2つないしそれ以上の元素で共有することで、疑似的に最外殻電子が埋まった状態を作ろうとするのです。
この電子を共有する結合のことを、共有結合といいます。
共有結合で分子をつくる
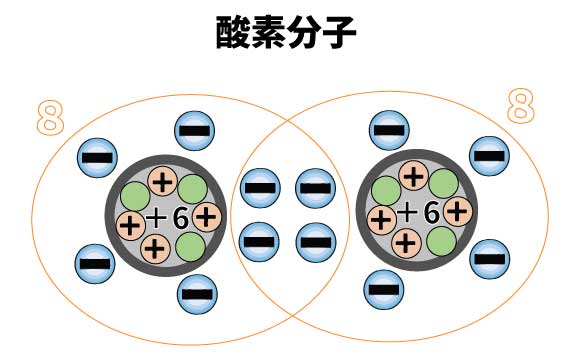
たとえば酸素。酸素原子の最外殻電子は「6」です。安定まで2つ足りません。
なので酸素原子2つで2つずつ電子を共有すれば、それぞれが8つ電子を持っているような状態になります。
こうやって酸素分子O2をつくるのです。
窒素の場合は最外殻電子は「5」です。なので3つの電子を共有する必要があります。
共有する電子の数が多いほど、強く結びつきます。なので酸素よりも窒素の方が化学反応が起こりにくい、安定した物質なのです。
炭素の場合は最外殻電子は「4」です。
炭素の場合は特殊で、電子3つを使って共有結合することもあれば、電子4つの共有結合をする場合もあります。
前者の場合がグラファイト。鉛筆の芯などです。これはのちに述べる金属結合的な性質を持つので、電気を通します。
後者が最も硬いと言われる物質、ダイヤモンドの結合です。

この炭素、窒素、酸素の最外殻電子の数、「4,5,6」。これが後に有機化学でも重要となるので覚えておいてください。
金属結合
先ほどの共有結合は、安定状態まで少し足りない最外殻電子を共有することで結びついていました。
では元素周期律表の左側、もっと最外殻電子の数が少ない元素はどうするのか。
足りない電子を共有するより、余った電子を放り出す方が簡単なのです。
そうすると、たくさんの原子核の周りを電子が軌道にとらわれずに自由に動くようになります。
これが金属結合です。
金属は電気を通す
電流とはそもそも、電子の移動です。
金属結合しているものは、電子が原子核にとらわれていません。そういった電子を「自由電子」と呼びます。
この自由電子が一定の方向性を持って動けば、それが電流となります。

この電子の挙動を掘り下げていけば、「エレベーター内では携帯の電波が弱い」とか「電子レンジでアルミホイルをチンすると燃える」などの理由が説明できるのですが、物理の授業になるのでやめておきましょう。
ここで覚えておいてほしいのは、「金属は電子を放り出しやすい」つまり「プラスの電荷を帯びやすい」ということです。
イオン結合
先ほど金属は電子を放出してプラスの電荷を帯びやすいと述べました。
何かしらの電荷を帯びた状態の元素ないし分子を「イオン」と呼びます。
電子を放出してプラスの電荷を帯びているなら「陽イオン」。逆に電子を受け取ってマイナスの電荷を帯びているなら「陰イオン」と呼びます。
イオンの陽と陰は引き合います。陽イオンと陰イオンが結びつくことを「イオン結合」と呼びます。
陰イオンになりやすいもの
先ほどからお話しているとおり、最外殻電子がいっぱいになると安定します。
金属は電子を放出しやすいと述べました。最外殻電子が1~3個なら、放出した方が簡単だからです。
一方で最外殻電子が6や7の場合は、酸素のように共有結合をつくることもあります。
あるいは単に電子だけをもらって、陰イオンとなることもあるのです。
代表的なものですと、Cl-(塩化物イオン)やOH-(水酸化物イオン)、SO42-(硫化物イオン)など。
ワインに関係するものだと、SO32-(亜硫酸イオン)など。
イオン結合と「塩」
陽イオンと陰イオンがイオン結合で結びついたもの。
陽イオンが金属元素のイオンである場合、結びついたものの総称を「塩(えん)」と呼びます。
代表的なのが、ナトリウムイオンと塩化物イオンが結びついた、塩化ナトリウム、つまり食塩です。
しかし塩化カルシウムや硫酸銅なども「塩」の一種です。

なお、ブドウの病害対策に欠かせない「ボルドー液」。
これは硫酸銅CuSO4と生石灰(水酸化カルシウム)Ca(OH)2の混合水溶液です。硫酸銅も典型的な「塩」です。
「塩」は水に溶けて再びイオンに戻ります。
このイオンがもとで、水溶液の「酸性」と「塩基性(アルカリ性)」が決まります。
水溶液の酸性とアルカリ性
酸性の代表的はものといえば、塩酸、硫酸、硝酸。
アルカリ性なら水酸化ナトリウムと水酸化カリウム。
これらが高校で習う「強酸」と「強塩基」です。
(アルカリと塩基はほぼ同意)
酸性・アルカリ性とはよく耳にしますが、どんな状態のことを指すのでしょうか。
酸性とは水素イオンが多い状態
イオン結合で結びついた物質は、水に溶かして水溶液とすると一部ないし全部が電離します。
電離とは、原子ないし分子が電気的に中性ではなく陽イオンないし陰イオンとなること。

そのときに酸性物質は水素イオンを放出します。
HCl→H+ + Cl-
例えば通常は気体である塩酸が水に溶けて水溶液となる場合はこのようにイオン化します。
強酸と弱酸
先ほど例に挙げた塩酸は、水溶液に溶かしただけ電離して、塩酸の濃度が水素イオンの濃度となります。
しかし実はこれは数少ない例外。「強酸」と呼ばれるものだけが、水溶液に含まれるすべてが解離します。
では強酸でないもの「弱酸」はどうなのか。一部だけが解離します。
CH3COOH⇄ CH3COO- + H+(例 酢酸の電離)
ある程度で電離が止まるというよりは、解離する量と再び結合する量が拮抗して、平衡状態になるというのが正しいです。
そしてどれくらいの割合で電離するかについて、その温度における電離定数というものがあります。
酸性水溶液の濃度が高いほど水素イオン濃度は高くなってはいきますが、そこはイコールではない。むしろ濃度が高いほど解離しないものの割合が高くなっていきます。
アルカリ性とは
アルカリ性、もしくは塩基性と呼ばれる状態は、水溶液中にOH-水酸化物イオンが多い状態を言います。
先ほどの強酸と同じように強アルカリ性のものもあり、その代表が水酸化ナトリウムや水酸化カリウムです。

これらも次のように水溶液濃度の分だけすべて解離します。
NaOH → Na+ + OH-
中和反応
酸性の溶液にアルカリ性の溶液を加えると、中和反応が起こって水素イオンと水酸化イオンが結びつき水となります。
H+ + OH- → H2O
この性質を利用して、酸性物質の量を測定することができます。(逆もしかり)

濃度は分かっていないが量は測定できる酸性水溶液があったとします。
濃度の分かっているアルカリ性水溶液をちょっとずつ加えていきます。あらかじめアルカリ性になったら色が変わる試薬などを入れておき、色が変わるまでにどれだけアルカリ成分を加えたかから、酸性物質の量を計算するのです。
これを中和滴定と呼びます。
ワインの酸度
ワインの酸度はg/Lで表されますが、正確には「酒石酸換算で表した滴定酸度」と表記されます。
つまり、中和滴定によってどれくらいの酸性物質が含まれていたかを導き、それが仮にすべて酒石酸だった場合のグラム数を計算して表示しているということです。
(日本では国税庁の表記に従って g/100ml で表記する場合もあります。1桁数字が違うだけで意味は同じです。)
中和滴定では、どんな酸性物質が入っているかは分かりません。ワインの場合は酒石酸、クエン酸、リンゴ酸などが中心ですが、その割合はわからないのです。
それゆえ、酸度の値が同じワイン二つの酸味の質が大きく違って感じられるのは当たり前です。成分が大きく違う可能性もあるのですから。
もちろん酸の感じ方は単純な酸味成分の量だけで語れません。糖度やアルコールをはじめとした他の要素にも影響を受けます。
酸度の値は味わいを推測する参考にはなりますが、数字で味わいが決まるわけではないのがワインの不思議なところです。
pHとは
ワインの詳しい情報を見ていくと、pH(ペーハー)という値を目にすることがあるでしょう。
これは水溶液の酸性・中性・アルカリ性の強さを表す指標で、1~14までありpH7が中性です。
[H+]を水素イオン濃度(単位はmol/L)として、pHは次のように表されます。
pH=-log10[H+]
さて、「log」というものが出てきたのでよくわかりませんよね。ここから少し数学のお話です。
対数とは
対数logは次のように定義されます。
ap=Mのとき、logaM=p
これを見たところでピンとくるわけがあませんよね。
「ap」(aのp乗)とは、aという数字をp回かけ合わせたという意味。a×a×・・・(p回)・・・×a=Mという意味。通常はMの数字はとても大きくなります。
このときaを「対数の底」といいます。
このような大きな(もしくはとても小さな)数字を扱う場合は、「何乗か」で表してやる方が見やすいのです。
例えば a=10 p=8とすると、最初の公式は、
108=100000000 log10100000000=8
このように表せます。
pHの場合は
水素イオン濃度が1mol/Lを超えることは基本なく、通常は10-3mol/L、10-4mol/Lといったオーダーです。
pHの公式に当てはめると、[H+]=1×10-3mol/Lのとき、この両辺を10を底とする対数をとると、
log10[H+]=log101+log1010-3=0-3=-3
正負を逆にすれば、pHは3だと求まります。
となります。
対数計算における公式をいくつもつかいました。こちらのサイトに解説してあります。
数学Ⅱの範囲だそうです。
どういう意味があるの?
私の力不足でイマイチわかりづらいでしょう。数式をだしたところでよくわからない。
要点だけまとめると、
ポイント
〇pHは水素イオン濃度
〇pHは対数の値なので、pH=3はpH=4の10倍、pH=5の100倍の水素イオン濃度がある
〇pHの値が小さいほど酸性が強い
これだけ知っておいてください。
ワインのpH
ちなみにワインのpHは2.9~4.0と非常に強い酸性です。
3.2~3.5くらいの値が理想だと言われており、酸が強いワインも弱いワインも、pHの値はそう大きく変わりません。
しかしこれが対数の値だということを踏まえると、実際の水素イオン濃度は数倍の開きがあります。

なので、「pHがこの値以下だと自然酵母が働きにくいから、培養酵母が必須」とか、「pHが高いと汚染が広がりやすい」など、大きな差が現れるのです。
アルカリ性の場合は?
実は水自体も自然とある程度の解離をしています。
H2O ⇄ H+ + OH-
純水で常温の場合、およそ1×10-7mol/Lほどが電離して、水素イオンおよび水酸化物イオンとして存在すると言われています。だから中性がpH=7なのです。
酸性状態・アルカリ性状態というのは、これらのイオンがどちらかに偏って存在している状態です。
その際も水素イオン濃度と水酸化物イオン濃度の積かけ合わせた値)は1×10-14になることが分かっています。
逆に言うと、水素イオン濃度から水酸化物イオン濃度も求めることができます。
仮にpH=10だったとすると、pH=-log10[H+]=10なので[H+]=1×10-10mol/L、そこから[OH-]=1×10-4mol/Lとなります。
もし仮に水酸化ナトリウム水溶液だったとすれば、これが水溶液の濃度となります。
有機化学につづく大事なところ
以上の通り、無機化学の分野においてはワインで普段目にする用語はあまり出てきません。というのもワインにおいて重要な成分は、圧倒的に有機化合物が多いからです。
なので無機化学の分野は概ね有機化学を理解するための土台。
特に大事なところは次の通りです。
ポイント
〇元素周期表の縦の列は最外殻電子の数が同じで性質が似ている。
〇最外殻電子が満席になると落ち着くから、そうなるように元素は結びつく
〇元素がくっついて分子をつくる方法の一つは、電子を共有する共有結合
実はpHやイオンの話は有機にはあまり出てこないので、ぼんやりとしか理解できなくても大丈夫です。

